- Home
- 革新的分子を創る
革新的分子を創る
開発した触媒は既に機能が約束された分子群、例えば医薬品候補分子や天然有機化合物の合成に利用します。それだけでなく未知の機能分子の創製やその機能解明にも挑戦し、全く新しい機能分子を創ることが最終的な目標です。
現在の研究例(着手中)
α–シヌクレイン凝集促進剤のメディシナルケミストリー (2019–)
パーキンソン病は、脳の神経細胞の機能障害が原因で発症することが知られています。神経細胞の機能障害は、神経細胞間でのドーパミンなどの神経伝達物質による情報伝達ができなくなることによって引き起こされます。現在パーキンソン病の治療法として用いられているのはL-DOPAの投与です。L-DOPAは体内で神経伝達物質であるドーパミンへと分解されるため、症状を緩和させることができます。しかし、これは疾患の進行を止めることはできず、根本的な治療法ではありません。パーキンソン病発症の詳細なメカニズムは未だ十分に解明されていませんが、最近、α–シヌクレインというタンパク質が神経細胞内で凝集・蓄積することで神経細胞間の情報伝達が阻害されることが報告されました。このα–シヌクレインの凝集を抑制可能な分子を見いだすことができればパーキンソン病を根本的に治療できる薬となることが期待されます。私達は、阻害剤でなく、α–シヌクレイン凝集促進作用をもつある分子に注目し、その化合物のメディシナルケミストリー研究に挑戦しています。
多置換ヘテロール合成法によるヘテロ中分子の高効率合成(2018–)
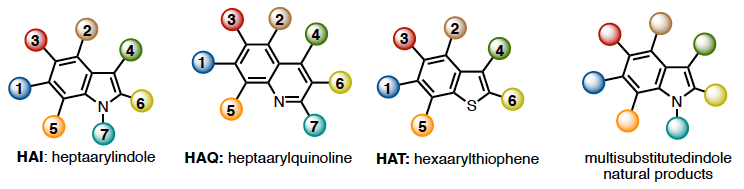
ベンゾヘテロール化合物は機能性分子、特にインドールは生命科学、チオフェンは材料科学のにおける最重要骨格です。従ってそれらの効率的合成法の開発は、現在においても有機合成化学における大 きな課題です。例えば、インドールの機能を司る置換インドールは、ベンゼノイド化合物の環化反応 (例:Fischer、Larock、Bartoli、Fukuyama など)数多に報告されているインドール合成法を用いるか、ハロゲン化/金属化インドールのクロスカップリング反応により合成が行われてきました。近年、遷移金 属触媒を用いた炭素̶水素(C‒ H)結合の直接官能基化により置換インドールを合成する手法が精力的に行われている。その結果、未だ制限がありつつも、インドールのC2‒ C7 位また窒素官能基N1 を 含むすべての部分を直接官能基化できるようになりました。しかしながら、多数の置換基を導入する多 置換インドール合成に関しては未だ効率的な手法は限られ、特に3つ以上の異なる官能基を効 率的に導入する手法は限られています。他のベンゾヘテロールの合成法に関しても同様の合成上の問題を抱えています。これらが、多置換ベンゾヘテロール化学の化学的・物理学的性質・応用への進展を妨げているといっても過言ではありません。
私達は、自身で開発したC‒ H 官能化反応を含めたカップリング法/環変換反応を利用した、多置換アリール芳香族化合物のプログラム合成(位置選択的に望みの置換基を導入する手法)を利用し、多置換ヘテロール合成法を開発し、ヘテロ中分子の高効率合成に挑戦しています。
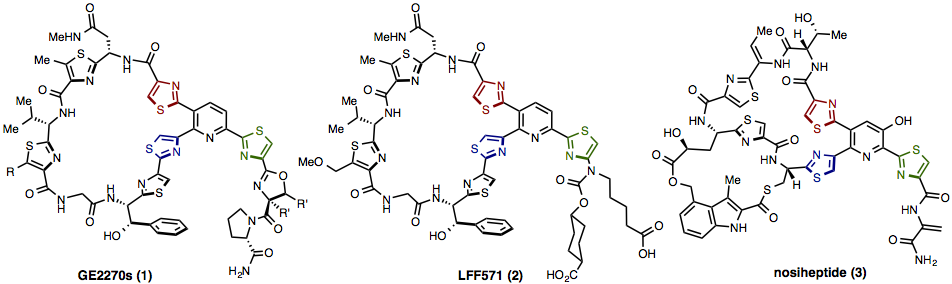
多様な複雑チオペプチド抗生物質の高効率合成 (2016–)
チオペプチド抗生物質群は現在急速に注目を集めているグラム陽性菌のタンパク質合成阻害剤です。例えばNovartis社はチオペプチド抗生物質GE2270類(1)をリード化合物とした半合成誘導体LFF571(2)を開発し、現在臨床試験(Phase II)中です。また、チオペプチド抗生物質のなかでも、ノシヘプチド(3)は二環式の環状ペプチド構造を有し、最も複雑構造をもっています。構造的特徴としてはアゾール環(チアゾール、オキサゾール)を置換基としたトリアリールピリジン骨格を含む大環状ペプチド構造を有しており、誘導体は50種類以上存在する極めてユニークな化合物群です。
このような背景により、半合成では困難なチオペプチド抗生物質群の主骨格の効率的合成法の確立が求められています。これまで主骨格である多置換ピリジン部位の構築は、付加環化反応によるピリジン合成や有機金属化合物と有機ハロゲン化物のクロスカップリング反応によって行われていました。しかしながら、いずれの合成法においても多段階を要する前駆体の調製を必要とし、多様性のある誘導体を合成するために、3つのアリール基を自在に変換可能な新しい多置換ピリジン骨格構築法が望まれています。また、環状ペプチドの結合形成には一般的な縮合反応が用いられ、反応が低収率または進行しないこともあります。
そこで本研究では、中分子化合物複雑チオペプチド抗生物質の多様性合成を目指し、新規トリアリールピリジン合成と、2つの化学ライゲーション法を駆使したペプチド部位の迅速合成法を確立することを目的とします。また、最難関中分子チオペプチド抗生物質ノシヘプチド(分子量1221)の合成に着手します。
新規生物時計制御分子の開発とケミカルバイオロジー研究 (2016–)
生物時計は睡眠や覚醒といった約一日の周期をもつ概日リズムを高度に制御する仕組みであり、私達が生活するうえで大変重要です。生物時計のしくみを理解しようとする試みは、動物ならば、その機能障害に由来する精神疾患の治療薬の開発に、植物なら開花や結実の制御に大きく寄与することから、世界中で盛んに行われています。最近、その生物時計を制御するために、生物時計を構成する時計遺伝子から作られる時計タンパク質に作用する分子を利用する手法が注目を集めています。しかし、現在これらの分子を発見する方法は市販の化合物ライブラリからのランダムスクリーニング法しかなく、化学の力で分子をデザイン・修飾し、それを基に新たな生物時計分子を創製することが求められています。私達はごく最近、ある植物の概日リズムを長周期化する分子を発見しました。この分子を最新の合成化学の技術を駆使して、誘導化し、新しい生物時計制御分子の開発を目指しています。さらに、その分子を用いて如何にして生物時計を制御しているのか化学と生物学的なアプローチにより解明したいと考えています。名古屋で化学と生物学が融合した研究室を起ち上げ、合成化学を専門とする私と、生物時計の第一人者が同研究室に属するという環境を整ったことではじまった学際的研究です。生物時計を分子で自在に操ることを究極の目標とし、本研究に注力したいと考えています。


 English
English 中文
中文